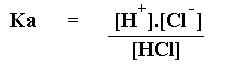
Equilíbrio Químico envolvendo ácidos e bases.
Antes de iniciar o estudo sobre o equilíbrio envolvendo ácidos e bases é importante saber o que são substâncias ácidas e substâncias básicas assim como o perigo que podem oferecer ao ser humano.
Substâncias ácidas :
De acordo com Arrhenius , substâncias ácidas são aquelas que em solução aquosa sofrem ionização liberando íons H+ . Estes íons por sua vez reagem com a água formando o íon H3O+ também chamado de Hidrônio.
HAc
= H+ + Ac-H+ + H2O
= H3O+Substâncias ácidas são consideradas perigosas pelo fato de terem a propriedade de destruir estruturas moleculares assim como dissolver matéria orgânica com muita facilidade dependendo da força e da concentração do ácido. Existem ácidos fortes que em alta concentração conseguem diluir metais bastantes resistentes como o Magnésio por exemplo. Isto ocorre devido à oxidação promovida pelos hidrônios .
Mg(s) + 2H+(aq)
= Mg2+(aq) + H2(g)É extremamente perigoso trabalhar com substâncias ácidas sem o uso de equipamentos de proteção tais como luvas, óculos, avental, etc. Qualquer contato dessas substâncias com qualquer parte do corpo humano causaria queimaduras bastante sérias e danosas.
Como determinar a força do ácido :
A força do ácido é um parâmetro determinado através da sua constante de ionização Ka . Quanto maior o valor Ka , maior a quantidade de íons H+ liberados na solução e como consequencia mais forte é o ácido.
A constante de ionização é um valor semelhante à constante de equilíbrio, portanto varia apenas com a temperatura.
Existem outras técnicas para perceber quando um ácido é forte ou não . Suponha um ácido do tipo HySOx , se o valor x-y for maior ou igual a 2 , o ácido pode ser considerado forte. Observação : No lugar do átomo S poderia estar outro átomo.
Além dessa técnica , se o ácido for do tipo HX onde X é um átomo qualquer da família dos halogênios, o ácido também é considerado forte.
O valor da constante de ionização Ka é obtido da mesma forma que se obtém a constante de equilíbrio em uma solução aquosa :
HCl
= H+ + Cl-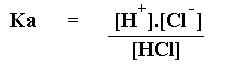
Substâncias básicas :
Ainda conforme Arrhenius , substâncias básicas são aquelas que em solução aquosa liberam o íon OH- chamado hidroxila.
BOH
= B+ + OH- Substâncias básicas também são consideradas perigosas assim como os ácidos e requerem cuidados tais como o uso dos mesmos equipamentos de proteção e evitar contato com partes do corpo. Estas precauções são necessárias porque substâncias básicas também causam queimaduras graves . Ao contrário dos ácidos , as bases liberam hidroxilas OH- que são responsáveis pela redução das outras espécies químicas que estão em contato.NH2OH
= NH2+ + OH-Assim como os ácidos são classificados em fortes ou fracos, as bases também podem ser classificadas em bases fortes ou fracas. Esta classificação é análoga aos ácidos , pois uma base forte é aquela que possui uma constante de dissociação alta.
A constante de dissociação Kb também é obtida de forma semelhante à constante de equilíbrio para soluções aquosas:
NH2OH
= NH2+ + OH-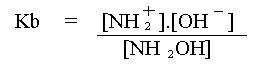
Algumas bases formadas por elementos pertencentes às famílias dos metais alcalinos e metais alcalinos terrosos são consideradas fortes.
Substâncias anfipróticas são aquelas consideradas ácidas e básicas ao mesmo tempo.
A caracterização de soluções ácidas ou básicas : pH e pOH.
Por conveniência, a concentração do íon Hidrogênio é expressa sempre na forma de pH. Este termo foi introduzido por um químico dinamarquês chamado Sorensen em 1909. A letra "p" significa potenz , palavra do vocabulário alemão que significa potência.
A relação entre a concentração de íons Hidrogênio e o valor pH é definido pela equação :
pH = - log[H+]
Da mesma forma podemos utilizar essa terminologia para caracterizar a concentração de íons OH- em uma solução básica :
pOH = - log[OH-]
Ou uma solução qualquer :
pK = - log K
Todos os logarítnos citados acima estão na base 10 e K pode ser qualquer valor de constante de equilíbrio.
A relação entre os valores de pH e pOH é definida como :
pH + pOH = 14
Isso ocorre porque à 25o C o produto iônico da água é 10-14
H2O
= H+ + OH-
Portanto o produto das concentrações dos íons H+ e OH- deve ser 10-14
Utilizando as propriedades dos logarítmos :
[H+].[ OH-] = 10-14
log [H+].[ OH-] = log 10-14
log [H+] + log [OH-] = -14
- log [H+] - log [OH-] = 14
pH + pOH = 14
Existem alguns ácidos fracos que possuem uma certa cor quando estão em sua forma molecular e uma cor diferente quando estão na forma ionizada. Isso pode ser muito útil, pois dependendo da cor da solução podemos saber se o ácido está ionizado ou não.
Mais do que isso, podemos saber a concentração do íon Hidrogênio na solução. Por isso dizemos que esses ácidos fracos são indicadores da concentração do íon Hidrogênio. Podemos chamar essas substâncias de Indicadores.
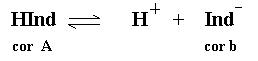
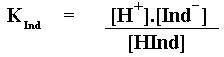
|
Indicador |
Meio Básico |
Meio Ácido |
|
Tornassol |
Azul |
Vermelho |
|
Fenolftaleína |
Incolor |
Vermelho |
|
Metil Orange |
vermelho |
Amarelo |
Uma solução tampão, solução tamponada ou simplesmente tampão é aquela solução capaz de manter aproximadamente constante o valor do seu pH quando é adicionado à ela um ácido ou base. Podemos dizer que a concentração do íon Hidrogênio não sofre grandes alterações devido à adição de substâncias ácidas ou básicas.
A solução tampão pode ser constituída de um ácido fraco e seu respectivo sal ou uma base fraca e seu respectivo sal.
A importância das soluções tampão não estão apenas associadas ao uso nos laboratórios de pesquisa. A natureza também utiliza soluções tampão em diversos lugares. Um exemplo de solução tampão é o plasma sanguíneo dos seres humanos.
A nossa corrente sanguínea deve ter um pH apropriado para a respiração acontecer. Se o sangue não fosse uma solução tamponada, ninguém sobreviveria após ingerir molho de tomate, suco de maracujá ou mesmo refrigerante. Esses alimentos são ácidos e alteram o pH do sangue. Se não existisse solução tampão a respiração não continuaria acontecendo e o corpo humano poderia ser levado à morte.
O pH sanguíneo deve ser 7,4 para a respiração ocorrer. Qualquer alteração no valor desse pH é rapidamente compensado pelo tampão presente na circulação sanguínea para que a respiração continue acontecendo.
No caso do tampão presente na circulação sanguínea, o ácido fraco envolvido e o sal são o ácido carbônico e o bicarbonato. No caso de excesso do íon H+ o seguinte equilíbrio é deslocado para a esquerda :
H2CO3
= H+ + HCO3-