 Faz de conta que a bolinha azul é o íon Cl- e
a bolinha branca é o íon Ag+ . As duas bolinhas
juntas formam o composto AgCl(s) . A quantidade de AgCl(s)
é sempre a mesma, assim como as quantidades dos íons. Tente
observar !
Faz de conta que a bolinha azul é o íon Cl- e
a bolinha branca é o íon Ag+ . As duas bolinhas
juntas formam o composto AgCl(s) . A quantidade de AgCl(s)
é sempre a mesma, assim como as quantidades dos íons. Tente
observar !
O princípio necessário para exisitir equilíbrio químico
em uma solução é a reversibilidade da reação
envolvida. Isto é, a reação ocorre tanto no seu sentido
direto como no inverso.
Continuando com o exemplo da água:
Reação de ionização da água - Reação direta:
H2O
à H+ + OH-
Reação inversa:
H+ + OH- à H2O
Por convenção, o equilíbrio pode ser representado com o símbolo de igualdade, como em qualquer equação de reação química.
H2O = H+ + OH-
Em uma situação de equilíbrio químico, as velocidades das reações direta e inversa são equivalentes. Como consequência, as concentrações de reagentes e produtos permanecerem constantes após um determinado intervalo de tempo que pode ser curto ou não.
Uma vez representando o equilíbrio químico através do sinal igual ( = ), isso indica que temos duas reações ocorrendo ao mesmo tempo. Chamamos de reação direta aquela que acontece no sentido da produção de produtos.(Lembre-se de que os produtos da reação de ionização da água são os íons H+ + OH-)
A outra reação, denominada reação inversa é aquela que ocorre no sentido da produção de reagentes.
Ao analisarmos a cinética do equilíbrio químico, podemos verificar a igualdade entre a velocidade da reação direta e a velocidade da reação inversa. Ao mesmo tempo que 1 mol da espécie H2O é consumido na produção de H+ + OH- pela reação direta , 1 mol da mesma espécie H2O é produzido pela reação inversa. Com isso a concentração de H2O permanece constante.
Uma outra espécie que pode servir como exemplo é o cloreto de prata (AgCl).
AgCl(s) = Ag+ + Cl-
Em uma solução de AgCl temos as duas reações ocorrendo ao mesmo tempo , uma produzindo íons Ag+ + Cl- e outra inversa produzindo o sal AgCl(s).
 Faz de conta que a bolinha azul é o íon Cl- e
a bolinha branca é o íon Ag+ . As duas bolinhas
juntas formam o composto AgCl(s) . A quantidade de AgCl(s)
é sempre a mesma, assim como as quantidades dos íons. Tente
observar !
Faz de conta que a bolinha azul é o íon Cl- e
a bolinha branca é o íon Ag+ . As duas bolinhas
juntas formam o composto AgCl(s) . A quantidade de AgCl(s)
é sempre a mesma, assim como as quantidades dos íons. Tente
observar !
Com isso, as concentrações das espécies são
constantes nesta situação, o que evidencia o equilíbrio
químico.
Constante de equilíbrio
O valor da constante de equilíbrio é obtido a partir das concentrações das espécies químicas presentes na solução quando o sistema está em equilíbrio.
A constante de equilíbrio foi deduzida a partir das velocidades das reações direta e inversa.
Recordando que para uma reação qualquer do tipo
aA + bB = cC + dD
A velocidade da reação é dada por
V = k.[A]a.[B]b
É importante lembrar que a água e espécies sólidas não são consideradas e apenas os reagentes participam da equação de velocidade. A velocidade depende exclusivamente dos reagentes e não dos produtos.
Vamos utilizar o exemplo da ionização do AgCl
AgCl(S) à Ag+ + Cl-
Para esta reação , V = k
Como AgCl é um sólido, não participa da equação de velocidade.
No entanto, para a reação inversa :
Ag+ + Cl- à AgCl(S)
A velocidade é dada por V = k[Ag+][Cl-]
A constante de equilíbrio, também chamada de Ke, é obtida pela divisão da velocidade da reação inversa pela velocidade da reação direta.

Uma maneira mais simples de obter a equação da Ke para a reação
AgCl(S) = Ag+ + Cl-
É calcular o quociente dos produtos pelos reagentes excluindo espécies sólidas e a água. O resultado é o mesmo.
Ke = [Ag+][Cl-]
Devemos lembrar que estas concentrações são aquelas
obtidas durante o equilíbrio químico, ou seja, são
constantes.
A partir disso podemos elaborar uma regra geral para obtermos a equação
da constante de equilíbrio:
|
Para qualquer equação do tipo :
aA + bB = cC + dD A constante de equilíbrio pode ser obtida por:
|
A unidade da constante de equilíbrio é geralmente expressa em (mol/L)x onde x é o resultado aritmético da expressão das letras minúsculas (c+d-a-b).
Tendo em mente o que significa a constante de equilíbrio (razão entre concentração de produtos e reagentes) podemos entender algumas de suas finalidades. Um exemplo clássico é analisar uma dada reação como por exemplo:
A equilíbrio químico representado abaixo ocorre nos pulmões de pessoas fumantes.
Hm.Co + O2 = Hm.O2 + CO
O valor da constante desse equilíbrio é dado por :
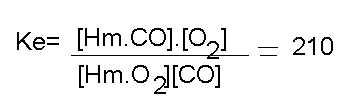
O símbolo Hm representa a Hemoglobina, substância responsável pelo transporte de Oxigênio no organismo. A partir destas informações , a que conclusão poderíamos chegar ?
A resposta é a seguinte : Se tivéssemos um sistema formado por Hemoglobina , Oxigênio e monóxido de Carbono, após algum tempo o equilíbrio seria alcançado (as concentrações permaneceriam constantes) e a quantidade de Hm.CO e O2 seria 210 vezes maior que a quantidade de HmO2 e CO. A capacidade de respiração é proporcional à quantidade de Hm.O2. Essa constante de equilíbrio mostra qua a concentração de Hm.O2 é muito pequena em relação à concentração de Hm.CO . Com isso o fumante tem respiração deficiente.
Fumar á prejudicial à saúde devido à formação
de Hm.CO(aq) no organismo, o que dificulta o processo respiratório.
Cada molécula de monóxido de Carbono (CO) que entra no organismo
do fumante corresponde a uma molécula de Oxigênio a menos
que ele não conseguirá mais respirar durante 1 mês
ou mais .